Je suis nouvel arrivant à l'université, que dois-je faire pour demander des analyses?
Rendez-vous ici : si c'est votre 1ère visite, vous serez invité à vous enregistrer. Cela nous permettra de régler vos droits d'accès à nos locaux et à notre disque réseau pour récupérer vos futurs spectres. Ensuite, 2 modes d'accès sont possibles :
- vous enregistrez votre demande en ligne ici, vous nous apportez votre tube et nous ferons votre spectre.
- vous passez une habilitation pour enregistrer vous-même vos spectres en libre-service.
Comment récupérer mes spectres ?
Vos spectres sont sauvés sur un serveur de l'université Lyon1. Contactez-nous pour avoir vos droits d'accès.
- Choisissez le 300 MHz si ...
- Votre molecule is petite (400g/mol ou moins )
- Vous avez au moins 40mg de produit pour faire un spectre 13C
- Vous n'avez pas besoin d'une très bone résolution.
- Vous voulez faire des analyses sur des noyaux abondants (1H, 13C, 11B, 31P, 19F).
- Vous n'avez pas besoin de régulation de température pendant votre analyse.
- Choisissez le 400MHz si ...
- Vous avez au moins 10 à 20 mg de produit pour faire votre spectre 13C sur une petite molécule ou au moins 100mg pour faire un spectre 15N.
- Vous voulez faire une Dosy sur un échantillon concentré.
- Vous voulez faire une analyse sur un noyau de faible sensibilité.
- Vous voulez travailler entre 5 et 80°C.
- Choisissez le 500MHz si ...
- vous avez 5mg ou moins d'une petite molécule pour faire un spectre 13C
- Vous avez 50mg ou moins pour faire un sectre 15N.
- Vous vous attendez à un spectre complexe.
- Vous voulez faire une DOSY sur un échantiloon très dilué.
- Vous voulez faire un 13C découplé fluor.
- Vous voulez faire des expériences combinées ( HSQC-TOCSY, HMBC-NOESY...) or new ones. - Vous voulez faire des analyses sur un noyau quadrupolaire ou peu sensible.
- Vous voulez faire une analyse à moins de 5°C.
Que faire si mon produit est peu soluble ?
Seule la partie solubilisée de votre produit sera analysée. Il est donc inutile de "charger" votre tube (c'est même nuisible car les partiules en suspension vont déteriorer les shims). Vous pouvez essayer de trouver un autre solvant (l'analyse est possible en solvant non deutéré si necessaire), ou chauffer votre tube et nous demander une analyse à haute température. Vous pouvez aussi essayer la RMN du solide, par exemple ici. .
Que dois-je faire pour passer mon habilitation ?
Faites quelques spectres avec quelqu'un de votre équipe de recherche puis prenez rendez-vous avec un membre du CCRMN. Nous vérifierons que vous n'avez pas de comportement dangereux pour le spectromètre, que vous etes autonome pour enregistrer un spectre, et que vous avez les connaissances pour produire un spectre qualité raisonnable.
L'accès aux spectromètres 400 and 500MHz est possible, mais avec un complément de formation, si vous êtes interessés contactez-nous..
Comment préparer mes échantillons ?
Les tubes doivet être propres et secs (ne pas les laisser séjourner dans l'étuve, ils risquent de se déformer ansi que les bouchons. Ils ne doivent pas être ébréchés. Ne pas hésiter à jeter les tubes trop courts ou cassés : les tubes jetables à 0,5 euros font très bien l'affaire pour la plupart des applications, et ous en donnons très souvent, contactez-nous si besoin.
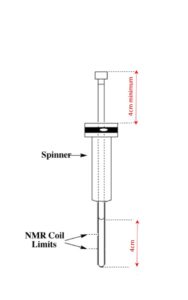
Le niveau de solvant doit être suffisant (4cm de haut) et pas trop haut, surtout si les analyses ne sont pas faites à température ambiante (convection dans le tubes)
La solution doit être limpide. Seule la partie dissoute de l'échantillon sera analysée.
Homogénéiser votre soluion pendant la préparation, il ne doit pas y avoir de gradient de concentration dans le tube.
Que faire si j'ai une très petite quantité de produit ?
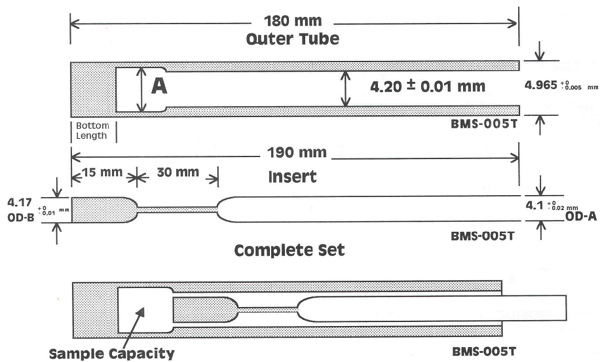
Run your analysis on the 500MHz, use a Shigemi tube that minimizes the volume of solvent required. If tests on the 500MHz are not satisfactory, we will apply for time slots to the NMR Very High Field Centre where we will access to a cryo-probe spectrometer.
What shall I mention in the experimental part of my publications?
You should at least mention the spectrometer and its 1H resonance frequency (Bruker Avance III 300, 400 or 500MHz), the probe (usually Bruker BBFO, sometimes BBI on the 500MHz) and the NMR sequence you used (single pulse, decoupling, COSY, HSQC...), the number of scans and/or the length of the experiment.
In case of quantitative analyses, mention the flip angle and the time between 2 successive scans. In case of 2D experiments, you can indicate the number of increments which gives the resolution in the indirect dimension (TDF1 parameter). You can also add some words on data processing, for example the use of an apodization function or a zero-filling treatment. Concerning DOSY, contact us. For more information, see IUPAC recommendations .
